El canvi de la matèria/Versió per a imprimir
El Sistema Internacional d'Unitats
[modifica]El Sistema Internacional d'Unitats, abreujat SI és el sistema d'unitats de mesura mes utilitzat.
Unitats de longitud
[modifica]El metre (m) és la unitat de longitud del Sistema Internacional de pesos i mesures.
Múltiples
Es poden utilitzar prefixos per anomenar múltiples o subdivisions del metre. Per exemple:
- quilòmetre (km) = 1000 m = m.
- hectòmetre (hm)= 100 m = m.
- decàmetre (dam) = 10 m
- metre (m)= 1m
- decímetre (dm) = 1/10 m = 0.1 = 1· m.
- centímetre (cm) = 1/100 m = 0.01 = 1· m.
- mil·límetre (mm) = 1/1000 m
Unitats de massa
[modifica]El quilogram és la unitat base de massa en el Sistema Internacional (SI). Els múltiples o submúltiples del quilogram més usats són,
- tona = 1000 kg.
- gram (g) = 1/1000 kg.
- mil·ligram (mg) = 1/1000 g.
Unitats de volum
[modifica]El volum (V), és la magnitud física que expressa l'espai que ocupa un cos. La unitat de mesura de volum en el Sistema Internacional es el metre cúbic (), tot i que el litre (l) i el mil·lilitre (ml) són molt utilitzats.
- 1 metre cúbic equival a 1000 litres.
- Un litre és un decímetre cúbic (dm)
- 1 litre equival a 1000 mililitres. Un mililitre és un centímetre cúbic (cm)
Factors de conversió
[modifica]En principi hem d'utilitzar les unitats del Sistema Internacional (SI), però moltes vegades n'utilitzem altres. Així, quan fem referència a la densitat d'un cos normalment ho fem en grams per centímetre cúbic en lloc d'utilitzar els quilograms per metre cúbic del Sistema Internacional. Per això es fa necessari la utilització dels factors de conversió.
La densitat
[modifica]La densitat és la relació que existeix entre la massa i el volum d'un cos. La densitat és directament proporcional al valor de la massa i inversament proporcional al volum del cos. Fórmula general:
Les unitats de mesura de la densitat en el Sistema Internacional és el quilogram per metre cúbic (kg/). La densitat de l'aigua és .
Dissolucions
[modifica]Dissolució
[modifica]Una dissolució és una mescla de dos o més components en el qual un dels components es troba en proporcions més elevades que els altres. El component que es troba en més quantitat es coneix com a dissolvent i la resta de components de la dissolució s'anomenen soluts. L'aigua és un bon dissolvent de moltes substàncies; per això són molt freqüents les dissolucions aquoses, en que l'aigua sempre és el dissolvent i els components restants són els soluts. L'estat del solut pot pertànyer a qualsevol estat de la matèria: sòlid, liquid o gas. Per exemple en una dissolució de sucre amb aigua, el solut (sucre) és sòlid. En una d'alcohol en aigua, el solut (alcohol) és líquid i en les begudes carbòniques el solut (diòxid de carboni) és un gas. Quan una dissolució té poc solut en relació amb la quantitat de dissolvent, es diu que és una dissolució diluïda; si té molt de solut es diu que és concentrada.
Concentració
[modifica]És la quantitat de solut que hi ha en una determinada quantitat de dissolució o dissolvent. Aquesta concentració es pot expressar de tres formes diferents:
- % en massa: massa de solut per 100 unitats iguals de massa de dissolució.
- % en volum: volum de solut per 100 unitats iguals de volum de dissolució.
- g/l: Grams de solut que hi ha en un litre de dissolució.
Si ens diuen que una dissolució d’aigua i sal té una concentració del 20% ens estan dient que hi ha 20g de sal per cada 100g de dissolució, és a dir, hi ha 20g de sal per cada 80g d’aigua.
Dissolucions saturades
[modifica]Si preparem una dissolució d’aigua i sal i anem afegint sal a l’aigua, arribarà un moment que la sal ja no es dissoldrà i quedarà al fons del got. Direm que en aquest punt tenim una dissolució saturada. La solubilitat d’un solut en un dissolvent és la màxima quantitat de solut que es pot dissoldre en una determinada quantitat de dissolvent a una temperatura determinada. La solubilitat sol donar-se en grams de solut per 100g de dissolvent. Així per exemple,si la solubilitat de la sal de cuina en aigua és de 358 grams per litre de dissolució (358 g/l). Això vol dir:
- Si en un litre de dissolució hi ha dissolts 358 grams de sal, la dissolució està saturada.
- Si s'hi afegeixen més de 358 grams de sal per litre, se'n dissoldran 358 g. La resta se
n'anirà al fons. La dissolució estarà saturada.
|
|
Aquesta pàgina necessita alguna millora en el contingut o l'estil. Potser a la pàgina de discussió trobareu més informació sobre les seves mancances. |
Sòlid, líquid i gas
[modifica]La matèria pot presentar-se en tres estats: sòlid, líquid i gasós. Les condicions de pressió i temperatura determinen que una mateixa substància es trobi en un o altre estat. L’aigua és una substància química que podem fàcilment trobar en estat sòlid,líquid i gasós en situacions quotidianes. Quan parlem de l’aigua en estat sòlid ens referim al gel, en estat líquid a l’aigua que bevem i en estat gasós al vapor d’aigua. Que l’aigua es trobi en un o altre estat depèn de les condicions de pressió i temperatura. A la pressió d’1 atmosfera, l’aigua és líquida entre 0° C i 100º C; per sota de 0° C es troba en estat gel i per sobre de 100o C en estat vapor.
Canvis d'estat
[modifica]Fusió
[modifica]És el pas de sòlid a líquid. Agafa uns glaçons de gel i deixa’ls en un vas a temperatura ambient. Els glaçons comencen a absorbir calor de l’atmosfera i la seva temperatura va augmentant moderadament fins a arribar a 0° C. A aquesta temperatura té lloc la fusió del gel. Pots observar-ho veient com els glaçons es fonen i es converteixen en aigua. Amb un termòmetre pots comprovar que mentre dura la fusió del gel, la temperatura del sistema gel - aigua es manté constant i igual a 0° C. Si quan s’ha fos tot el gel tornes a refredar l’aigua líquida, que està a 0° C, aquesta aigua es torna altra vegada gel. L’aigua es solidifica.
La solidificació
[modifica]És el pas de líquid a sòlid. El punt de solidificació és la temperatura a la qual un líquid comença a esdevenir sòlid, i coincideix amb el punt de fusió.
La vaporització
[modifica]És el pas de líquid a gas. Aquest canvi d’estat pot tenir lloc de dues maneres diferents: mitjançant evaporació o mitjançant ebullició. L'evaporació es una vaporització lenta. Les molècules líquides passen a vapor lentament. Només passen a vapor les molècules de la superfície del líquid. Té lloc a qualsevol temperatura. L'ebullició es una vaporització ràpida i tumultuosa. Té lloc a tot el líquid. És a dir,passen a vapor molècules de qualsevol punt del líquid. La temperatura d’ebullició és característica de cada líquid i depèn de la pressió a la que es troba. L’ebullició de l’aigua es produeix a 100º C si la pressió és d’una atmosfera (1 atm). Fa uns dies vaig explicar en aquesta entrada per què augmenta l’energia cinètica (moviment), dels materials quan s’escalfen, ho vaig explicar de dues maneres; considerant la calor una ona i una partícula:
Com a ona: Al ser la calor una ona electromagnètica, té un camp elèctric oscil·lant, de forma que els nuclis atòmics del nostre cos es desplacen en la direcció i el sentit el camp. Com més ràpid canvia el sentit del camp, més ràpidament els nostres àtoms es mouen d’un lloc a un altre, de tal forma que oscil·len (es mouen) i amb el fregament alliberen calor. Com a partícula (fotons): Els fotons de la radiació infrarroja arriben als àtoms del nostre cos i hi impacten, transferint-los-hi la quantitat de moviment. Us podeu imaginar el xoc d’un fotó amb el nostre cos com el xoc d’una canica a una bola de billar, la bola de billar no es mou perquè és molt gran però la canica li transfereix la quantitat de moviment. A mesura que els fotons van impactant es mouen els àtoms del nostre cos, i pel mateix motiu que abans, ens escalfem. Bé, avui he fet una gràfica de com varia l’energia cinètica d’un gas quan n’augmentem la temperatura; la gràfica és aquesta:
Segurament entendreu la gràfica més clarament si enlloc d’energia cinètica hi poso la velocitat en m/s d’un gas tant abundant en l’aire com és el nitrogen:
Aquesta gràfica ens dóna força pistes per entendre els canvis de fase gas a líquid.
Les molècules del gas pateixen unes forces intermoleculars o de Van der Waals que intenten ajuntar les molècules perquè ocupin el mínim espai possible. Aquestes forces són independents de la temperatura.
Però les molècules del gas també pateixen la dispersió provocada per l’agitació tèrmica de les molècules, la qual augmenta amb la temperatura com mostra el gràfic anterior.
Doncs bé, un gas condensa a líquid quan les forces intermoleculars (que volen mantenir la substància unida) són més fortes que l’agitació tèrmica (les quals dispersen les molècules de la substància)
Això pot passar per dos motius:
Disminució de la temperatura. Com que l’agitació tèrmica disminueix quan disminuïm la temperatura i les forces intermol·leculars són independents de la temperatura, al disminuir la temperatura disminueix l’agitació tèrmica i les forces intermol·leculars tenen les de guanyar al tenir un rival més dèbil. Augmentant la pressió. Un gas no és més que molècules corrent aleatòriament i que només canvien de direcció o sentit quan xoquen amb d’altres molècules o amb les parets. Com us podeu imaginar, quan augmenta la pressió les molècules de gas estan més juntes, de manera que les forces intermol·leculars es fan molt més intenses i poden superar més fàcilment l’agitació tèrmica. I aprofitant que l’entrada s’ha penjat automàticament mentre jo estic de festa aprofito per desitjar-vos un bon any!
Condensació
[modifica]És el procés físic que consisteix en el pas de una substància en forma de gas a forma líquida. La condensació es produeix al baixar la temperatura.
Les variacions de la temperatura en els canvis d’estat.
[modifica]La temperatura de una substància es manté constant durant els canvis d’estat de fusió i ebullició. Els canvis d’estat són canvis físics, això vol dir que no alteren la naturalesa química de la substància. L’aigua, com qualsevol altra substància, en passar de l’estat sòlid a l’estat líquid o d’aquest a l’estat gas o en fer els canvis inversos no canvia la seva naturalesa, no deixa d’ésser aigua. El que sí que canvien són algunes de les seves propietats com la densitat, la duresa, la capacitat de fluir, etc. Les substàncies pures tenen una temperatura de fusió i ebullició fixes a una pressió determinada. Podem variar la temperatura de fusió o d’ebullició d’una substància afegint-li una altra substància o bé variant-li la pressió. Així si afegim sal a l'aigua canviem la temperatura de fusió i d’ebullició aconseguint que congeli a una temperatura més baixa de 0° C. Si augmentem la pressió sobre l'aigua aconseguim que la temperatura d'ebullició augmenti, aquest fet és el que fa que les verdures es couin abans en una olla a pressió.
La teoria cinètico-molecular
[modifica]La teoria cinètico-molecular és la teoria que explica el comportament de les partícules en els diferents estats de la matèria.
Sòlids
[modifica]En els sòlids, les partícules estan molt properes entre elles i vibren, és a dir, ni estan quietes ni es mouen molt. Els sòlids es caracteritzen pel fet que tenen forma pròpia i ocupen un volum constant. No flueixen.
Líquids
[modifica]En els líquids, les partícules estan properes, però no tant com en els sòlids. Estan unides entre elles per forces atractives més febles que en els sòlids, però es poden separar fàcilment. Aquest fet es pot comprovar introduint la mà dins l'aigua; es pot veure com les partícules se separen perquè un nou cos està ocupant espai. Aquestes forces permeten que les partícules puguin lliscar unes per sobre de les altres. Els líquids tenen formes variables i s'adapten als recipients que els contenen. Tenen un volum constant i flueixen fàcilment. per millorar la seva densitat
Gasos
[modifica]En els gasos, les partícules estan molt separades unes de les altres. Les partícules es poden moure en totes direccions, xocant amb les parets dels recipients que les contenen. La teoria cinètica permet justificar que els gasos tinguin forma i volum variable, i que es puguin expandir i comprimir amb facilitat. Flueixen fàcilment.
Classificació de la matèria
[modifica]La matèria segons la seva composició pot estar formada per substàncies pures i mescles de substàncies pures. La majoria de substàncies que trobem a la naturalesa són mescles de diferents substàncies. L’aire és una mescla, l’aigua que bevem és una mescla, els sucs de fruita són mescles. La química considera substàncies pures aquelles que només contenen un tipus de substància. L’aire no és una substància pura,perquè està format per una barreja de gasos: nitrogen, oxigen i diòxid de carboni, entre altres gasos. L’aigua que bevem és una mescla perquè, a més d’aigua, sol contenir minerals. L’aigua destil·lada és una substància pura, perquè només està formada per aigua.El coure és també una substància pura, perquè només està format per coure. Les substàncies pures són els elements i els compostos. Les substàncies pures es diferencien de les mescles perquè tenen unes propietats característiques i constants. La temperatura de fusió, la temperatura d’ebullició i la densitat són propietats característiques de les substàncies pures.
Mètodes de separació dels components d'una mescla.
[modifica]Els components d’una mescla heterogènia,exemple aigua i sorra, podem separar-los mitjançant el mètode de sedimentació o bé el de la filtració, mentre que si es tracta d'una mescla homogènia, exemple sal i aigua, ho haurem de fer per destil·lació.
La sedimentació
[modifica]Si volem separar una mescla de sorra i aigua per aquest procediment el que farem es deixar en repòs la mescla d’aigua i sorra. Per efecte de la gravetat,la sorra es dipositarà al fons del recipient (sedimentarà) i l’aigua quedarà a la part superior. Acabada la sedimentació, anirem inclinant a poc a poc el vas que conté la mescla i recollirem l’aigua en un altre recipient. La sorra ens quedarà al vas.
La filtració
[modifica]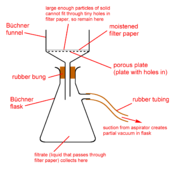
Consisteix a fer passar la mescla per un embut, al qual hem col·locat un paper de filtre. Si, per exemple, volem separar una dissolució de sorra amb aigua el paper de filtre ha de tenir uns porus amb el diàmetre inferior al de les partícules de sorra.
La destil·lació
[modifica]
1. termòmetre
2. Cap de destil·lació
3. Flascó de destil·lació
4. Font de calor
5. condensador
6. receptor
7. adaptador de buit
Permet separar els components d’una mescla, sempre que aquests tinguin diferent punt d’ebullició. Si, per exemple, volem separar per destil·lació una mescla d'aigua i sal el que farem serà escalfar la mescla suaument. Veurem que a una temperatura una mica superior als 100º C comença a bullir l’aigua i comença a evaporar-se. En el mateix muntatge de la destil·lació es refreda el vapor d’aigua format en l’ebullició al passar aquest vapor per un tub al voltant del qual hi circula aigua freda que fa que el vapor passi a forma líquida i aquest aigua condensada es recull amb un recipient i la sal ens queda al mateix recipient on hem fet la destil·lació.
La matèria que ens envolta està formada per unes partícules molt petites anomenades àtoms.Els àtoms tenen una mida tan petita que és impossible veure’ls, fins i tot amb els microscopis lluminosos més potents. Les principals característiques dels àtoms són:
- Els àtoms d’un element químic qualsevol són iguals entre ells i diferents dels àtoms d’altres elements.
- Els àtoms dels diferents elements químics es combinen entre ells per formar agrupacions més grans, les molècules, que són les partícules que formen els compostos químics.
- L’àtom té dues parts: el nucli i l’escorça.
- El nucli és molt petit respecte de l’àtom. En comparació amb tot l’àtom, el nucli és com un cigró en comparació amb un estadi de futbol. És per això que podem dir que l’àtom és pràcticament buit.
- Al nucli hi ha dos tipus de partícules: els protons i els neutrons.
- Els protons són partícules amb càrrega positiva.
- Els neutrons són partícules neutres, és a dir, sense càrrega elèctrica.
- A l’escorça hi ha els electrons.
- Els electrons són partícules amb càrrega negativa.
El nombre de protons d’un àtom és igual al d’electrons, la qual cosa fa que l’àtom sigui neutre. La massa del protó és semblant a la del neutró. Dins dels àtoms, els electrons giren descrivint òrbites al voltant del nucli. Les òrbites o nivells d’energia es =representen per la lletra n i prenen valors enters: n = 1, 2, 3, 4, 5, 6, 7, ... A cada òrbita (n) pot haver-hi un nombre màxim d’electrons(N). Aquest nombre ve donat per la següent expressió:
- N = 2n
- 1r nivell n = 2·1 = 2 electrons
- 2n nivell n = 2·2 =8 electrons
- 3r nivell n = 2·3 =18 electrons
- 4t nivell n = 2·4 = 32 electrons
- N = 2n
Elements químics
[modifica]Els elements químics són substàncies pures que no es poden descompondre en altres substàncies més simples. La part més petita que podem tenir d’un element químic que continua mantenint totes les propietats de l’element és un àtom de l’element. Cada element es representa universalment mitjançant un símbol, que consisteix en una o dues lletres del seu nom. A la taula següent hi ha alguns elements químics i els seus símbols.
| Nom de l'element | Símbol | Nom de l'element | Símbol |
|---|---|---|---|
| Alumini | Al | Brom | Br |
| Calci | Ca | Carboni | C |
| Clor | Cl | Coure | Cu |
| Ferro | Fe | Hidrogen | H |
| Mercuri | Hg | Nitrogen | N |
| Or | Au | Oxigen | O |
| Sodi | Na | Potassi | K |
Alguns elements químics es troben en la natura en estat lliure, però la majoria es troben combinats amb altres elements formant els compostos químics. Els compostos químics els representem amb fórmules. En les fórmules hi ha els símbols dels elements que formen el compost. Per exemple, el ferro, sobretot quan està humit, es combina amb l’oxigen donant òxid de ferro (). L’òxid de ferro no és un element químic, sinó que és un compost químic ja que conté dos elements químics: el ferro (Fe) i l’oxigen (O).
El nombre atòmic i el nombre màssic
[modifica]El nombre atòmic és el nombre de protons que té un àtom en el nucli. Tots els àtoms d’un mateix element químic tenen igual nombre de protons en el nucli, per tant, tenen igual nombre atòmic. El nombre atòmic es epresenta amb la lletra Z. El nombre atòmic coincideix també amb el nombre d’electrons de l’àtom. L’àtom,per tant, té igual nombre de protons que d’electrons, la qual cosa justifica que sigui neutre. El nombre màssic és la suma del nombre de protons, que representem amb la lletra Z, més el nombre de neutrons que representem amb la lletra N. El nombre màssic es representa amb la lletra A. A = Z + N Els nombres atòmic i màssic d’un element s'expressen de la següent manera:
- X representa el símbol de l’element químic.
- A el nombre màssic.
- Z el nombre atòmic.
Isòtops
[modifica]Anomenem isòtops a dos o més àtoms d’un mateix element químic que tenen diferent nombre màssic, és a dir, diferent nombre de neutrons.
Massa atòmica i molecular
[modifica]La unitat de massa atòmica es representa amb la lletra u i equival aproximadament al pes d'un protó o un neutró. Una unitat atòmica equival a kg.
Massa molecular
[modifica]La massa molecular és la massa d'una molècula, que és la suma de les masses atòmiques dels àtoms que la integren.
Mol d'àtoms i de molècules.
[modifica]S'anomena mol d'àtoms al pes que hi ha en àtoms. El valor numèric de la massa d'un àtom expressat en unitats de massa atòmica coincideix amb la del mol d'àtoms expressat en grams.
Ions
[modifica]Els ions són àtoms que han perdut o guanyat electrons. Hi ha dos tipus d’ions: cations i anions. Un catió és un àtom que ha perdut un o més electrons i ha quedat carregat positivament. Un catió és un ió positiu. Els cations es simbolitzen afegint un signe positiu per cada electró perdut al símbol de l’element. El signe positiu es posa en forma de superíndex. Per exemple: Li correspon al catió liti. El catió Li s’ha format a partir d’un àtom de liti que ha perdut un electró. Ca correspon al catió calci. El catió Ca s’ha format a partir d’un àtom de calci que ha perdut dos electrons. Un anió és un àtom que ha guanyat un o més electrons i ha quedat carregat negativament. Un anió és un ió negatiu. Els anions es simbolitzen afegint un signe negatiu per cada electró guanyat al símbol de l’element. El signe negatiu es posa en forma de superíndex. Per exemple: correspon a l’anió clorur. L’anió s’ha format a partir d’un àtom de clor que ha guanyat un electró.

















