Metal·lúrgia i siderúrgia/Propietats dels metalls

Metall
[modifica]S'anomena metall als elements químics que poden formar cations i enllaços iònics. Els metalls constitueixen un dels grups principals d'elements, junt amb els no metalls, semimetalls i gasos nobles. En la taula periòdica, els elements que van en diagonal del bor al poloni es consideren semimetalls, els que se situen a l'esquerra són els metalls, i els que apareixen a la dreta són els no metalls. Els metalls generalment són brillants, tenen densitat i punt de fusió alts, són dúctils, durs i bons conductors de l'escalfor i de l'electricitat. Aquestes propietats es deuen a l'enllaç metàl·lic propi dels metalls, on els electrons exteriors dels metalls estan lligats només lleugerament als àtoms, formant un mar d'electrons de gran mobilitat que banya a tots els àtoms. Els metalls formen la major part de la taula periòdica, i es poden classificar en diverses sèries químiques:

Metalls alcalins
[modifica]Els metalls alcalins corresponen al Grup 1 de la Taula Periòdica (anteriorment grup IA).
Aquests metalls són: Liti (Li), sodi (Na), potassi (K), rubidi (Rb), cesi (Cs) i Franci (Fr).
Constitueixen el 4,8 per cent de l'escorça terrestre, incloent la capa aquosa i atmosfera. El sodi i el potassi són els més abundants, la resta és rar.
Física i química.
Metalls alcalinoterris
[modifica]Les terres alcalines o alcalinoterris són els elements del grup segon de la Taula Periòdica, Beril·li (Be), Magnesi (Mg), Calci (Ca), Estronci (Sr), Bari (Ba) i Radi (Ra). Tots ells tenen dos electrons en la capa de valència. Tendeixen a perdre aquests electrons per formar cations divalents. Són d'aspecte argentat, tous i de baixa densitat. Reaccionen amb halògens per formar sals iòniques, i amb aigua per formar hidròxids bàsics. En general, són molt menys reactius que els metalls alcalins.
Lantànids
[modifica]La sèrie dels lantànids compren els elements entre el Lantani i l'Iterbi (nombres atòmics 57 a 70 inclosos). Són elements amb els orbitals f parcialment ocupats, però els orbitals de valència p i d desocupats. Habitualment se situen sota del bloc principal en la taula periòdica.
Els lantànids són: Lantani (La), Ceri (Ce), Praseodimi (Pr), Neodimi (Nd), Prometi (Pm), Samari (Sm), Europi (Eu), Gadolini (Gd), Terbi (Tb), Disprosi (Dy), Holmi (Ho), Erbi (Er), Tuli (Tm), Iterbi (Yb)i el Luteci[1] (Lu).
Actínids
[modifica]
La serie dels Actínids compren els 14 elements entre l'Actini i el Nobeli (nombres atòmics del 89 al 102, ambdós inclosos). Son químicament similars als lantànids. Els actínids mes pesants no es donen naturalment i tenen períodes de semidesintegració molt breus. Els Actínids se situen habitualment sota del bloc principal de la taula periòdica, sota dels lantànids.
Els actínids són : Actini (Ac), Tori (Th), Protoactini (Pa), Urani (U), Neptuni (Np), Plutoni (Pu), Americi (Am), Curi (Cm), Berkeli (Bk), Californi (Cf), Einsteini (Es), Fermi (Fm), Mendelevi (Md), Nobeli (No)
Metalls de transició
[modifica]Se sol anomenar metall de transició, o metall del bloc d als elements químics 29 a 30, 39 a 48 i 71 a 80 de la taula periòdica.
| Grup | Període 4 | Període 5 | Període 6 | Període 7 | |
|---|---|---|---|---|---|
| 3 (III B) | Sc 21 | Y 39 | Lu 71 | La 103 | |
| 4 (IV B) | Ti 22 | Zr 40 | Hf 72 | ||
| 5 (V B) | V 23 | Nb 41 | Ta 73 | ||
| 6 (VI B) | Cr 24 | Mo 42 | W 74 | ||
| 7 (VII B) | Mn 25 | Tc 43 | Re 75 | ||
| 8 (VIII B) | Fe 26 | Ru 44 | Os 76 | ||
| 9 (VIII B) | Co 27 | Rh 45 | Ir 77 | ||
| 10 (VIII B) | Ni 28 | Pd 46 | Pt 78 | ||
| 11 (I B) | Cu 29 | Ag 47 | Au 79 | ||
| 12 (II B) | Zn 30 | Cd 48 | Hg 80 |
Són elements amb orbitals de tipus d semiplens. Solen ser maleables, i amb densitat, punt de fusió i punt d'ebullició elevats. Les seves principals propietats Química|químiques són,
- Formació de compostos acolorits
- Poden tenir diversos estats d'oxidació
- Solen ser bons catalitzadors
- Poden formar complex químic complexos
Metalls del bloc p, o altres metalls
[modifica]
Els elements metàl·lics situats a la taula periòdica, juntament amb els metal·loides (o semimetalls), dins del bloc p es distingixen dels metalls d'altres blocs de la taula; en alguns casos són denominats "altres metalls". Tendeixen a ser blans i a tenir punts de fusió baixos.
Aquests elements són: Alumini, Gal·li, Indi, Estany, Tal·li, Plom i el Bismut.
Encara que la divisió entre metalls i no metalls pot variar, els elements amb nombre atòmic des del 113 al 116 poden incloure's en aquest grup, però no hi solen ser considerats. Aquests elements tenen un nom sistemàtic
Propietats Químiques
[modifica]
És característic dels metalls tenir valències positives en la majoria dels seus compostos. Això vol dir que tendeixen a cedir electrons als àtoms amb els que s'enllacen. També tendeixen a formar òxids bàsics. Per contra, elements no metàl.lics com el nitrogen, sofre i clor tenen valències negatives en la majoria dels seus compostos, i tendeixen a adquirir electrons ia formar òxids àcids
Els metalls tenen energia d'ionització baixa: reaccionen amb facilitat perdent electrons per formar ions positius o cations. D'aquesta manera, els metalls formen sals com clorurs, sulfurs i carbonats, actuant com a agents reductors (donants d'electrons).
El metalls tenen tendència a formar cations perdent electrons en reaccionar amb l'oxigen de l'aire per a formar òxids. La velocitat de reacció varia des del ferro que es rovella durant anys, fins al potassi que es consumeix en segons.
Exemples:
- 4Na + O2 → 2Na2O (òxid de sodi)
- 2Ca + O2 → 2CaO (òxid de calci)
- 4Al + 3O2 → 2Al2O3 (òxid d'alumini)
Els metalls de transició, com el ferro, el coure, el zinc i el níquel, triguen molt temps a oxidar-se, altres com el pal·ladi, el platí o l'or no s'oxiden perquè no reaccionen amb l'atmosfera. Alguns metalls formen una barrera d'òxid a la seva superfície que evita que ja no puguin penetrar més molècules d'oxigen de manera que poden mantenir la seva lluïssor metàl·lica i una bona conductivitat durant dècades, en serien exemples l'alumini, alguns acers i el titani. L'òxid dels metalls és habitualment de tipus bàsic mentre que els dels no-metalls acostumen a ser de tipus àcid. La pintura, l'anoditzat o el revestiment són tècniques que permeten prevenir la corrosió dels metalls.
Propietats Físiques
[modifica]
Densitat
[modifica]La densitat, de símbol ρ (lletra rho de l'alfabet grec), i de vegades abreviada com a d, és la massa específica d'un cos o fluid, és a dir, la quantitat de matèria que hi ha per unitat de volum. La densitat és directament proporcional al valor de la massa i inversament proporcional al volum del cos.
Fórmula general:
La majoria dels metalls tenen una densitat més gran que la dels no-metalls. Però hi ha una gran variació a la densitat dels diferents metalls, el liti és el menys dens mentre que a l'extrem oposat trobem l'osmi com al que presenta una densitat més gran. L'alta densitat de molts metalls és deguda a l'atapeït de la xarxa cristal·lina de la seva estructura metàl·lica. La força dels enllaços metàl·lics arriba al màxim vers el centre de la sèrie dels metalls de transició, atès que aquests elements tenen gran quantitat d'electrons deslocalitzats als enllaços metàl·lics. Tanmateix també hi ha d'altres factors involucrats com per exemple el radi atòmic, la càrrega nuclear efectiva o la forma del cristall entre d'altres.
Resistència mecànica
[modifica]La resistència dels materials a les forces a que se'l pot sotmetre és diferent segons sigui la direcció i el sentit de la força que hi exercim. Per aquest motiu, es distingeixen diversos tipus de resistència
- Anàlisi estructural
L'anàlisi estructural es refereix a l'utilització de les equacions de resistència dels materials per determinar els esforços interns que actuen sobre una estructura resistents, com edificacions o escalets resistent de maquinaria.
- Resistència a la tracció
Una força de tracció sobre una barra o un fil, és la força que aplica quan tibem els seus extrems cap enfora. Cada material té una resistència màxima a la tracció, de manera que si hi exercim forces de tracció superiors, el trencarem. La resistència a la tracció es mesura per la força màxima que aguanta el material sense trencar-se en cada centímetre quadrat (o per cada metre quadrat) de secció d'una barra o un fil fets amb aquest material. L'acer, per exemple, té una resistència a tracció superior a la de la fusta.
- Resistència a la compressió
Una força de compressió sobre una barra es la força que apliquem quan pressionem la barra per dos extrems cap al mig. Exercir forces de compressió es gairebé el contrari que exercir-les de tracció. Si comprimim massa el material, correm el risc de aixafar-lo. Cada material té una resistència màxima a la compressió, de manera que, si hi exercim forces de compressió superiors, l'aixafarem
- Resistència a la flexió
Les forces de flexió son les que aplicarem sobre una barra per corbar-la. Per exemple, si prenèssim un pes important del mig de la barra, de segur que la barra es vinclaria. La resistència al a flexió es la força de flexió màxima que es capaç de suportar una barra de material sense trencar-se. és una característica destacada de les barres i de les bigues i, més en general, de tots els materials amb els quals es fabriquen peces que han de suportar càrregues o pesos importants. Per exemple, un objecte que ha de tenir gran resistència a la flexió es el trampolí d'una piscina, la palanca des d'on se salta ha de suportar el pes del saltador i, a més,la força amb què s'impulsaven els bots previs que fa per saltar.
- Resistència a la torsió
Les forces de torsió (mecànica) són les que exercirem sobre un material per torçar-lo sobre ell mateix. Si nosaltres agafem una barra quadriculada pels extrems i un el girem, com quan escórres una peça de roba que està xopa, cap a la dreta i l'altre cap a l'esquerra. En intentar-ho exercirem forces de torsió sobre la barra. La resistència al a torsió es el màxim esforç de torsió que pot suportar un material.
- Resistència a la cisalla
Les forces de cisalla són les forces que s'exerceixen en les unions (cargols, reblons, soldadures) en el sentit adient per tancar-les. Són forces perpendiculars a la direcció del cargol o del rebló. La resistència a la cisalla es la força màxima de cisalla que és capaç de suportar la peça d'unió (clau, cargol, mascle, soldadura,...) sense trencar-se.
Mal.leabilitat i ductilitat
[modifica]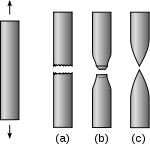
La mal·leabilitat és la propietat física, que juntament amb la ductilitat, indica la capacitat d'un cos o d'un material (especialment metalls) de ser fàcilment deformable. Es diferencia d'aquella en què mentre la ductilitat es refereix a l'obtenció de fils, la mal·leabilitat permet l'obtenció de fines làmines de material sense trencar-se. No existeix cap mètode per a quantificar cap de les dos propietats.
La ductilitat és una propietat físico-mecànica dels materials. És la capacitat que té un material de deformar-se plàsticament. La ductilitat és la propietat que presenten alguns metalls i aliatges quan, sota l'acció d'una força, poden deformar-se sense trencar-se permetent obtenir filferros o fils. Als metalls que presenten aquesta propietat se'ls denomina dúctils. Hi ha metalls com l'alumini, el níquel, l'acer, el coure, l'argent i l'or que tenen una gran ductilitat.
Tenacitat
[modifica]La tenacitat és la capacitat de resistència al xoc. Un xoc és un esforç aplicat de manera sobtada, instantani i violent. Els materials tenaços són capaços d'absorbir molta energia cinètica de l'objecte que provoca el xoc i la transformen en deformació plàstica o elàstica, evitant el trencament. Els materials fràgils es trenquen sense deformació quan són sotmesos a un xoc i no absorbeixen energia cinètica.
Conductivitat
[modifica]
La conductivitat, com el seu propi nom indica, els la capacitat dels material en conduir electricitat o calor. Per això doncs, hi ha dos tipus de conductivitat per a estudiar en els diferents tipus de materials, que són : la conductivitat tèrmica i la conductivitat elèctrica.
Conductivitat elèctrica
[modifica]La conductivitat elèctrica és una mesura de la capacitat d'un material de deixar passar el corrent elèctric, la seva aptitud per deixar circular lliurement les càrregues elèctriques. La conductivitat depèn de l'estructura atòmica i molecular del material, els metalls són bons conductors perquè tenen una estructura amb molts electrons amb lligams febles i això permet el seu moviment. La conductivitat també depèn d'altres factors físics del propi material i de la temperatura. Quan s'estableix una diferència de potencial al llarg d'un conductor, el flux de les càrregues mòbils genera un corrent elèctric. La conductivitat σ es defineix com la relació de la densitat de corrent respecte de la força del camp elèctric.
Conductivitat Tèrmica
[modifica]La conductivitat tèrmica (simbolitzada λ o k) és la mesura de la facilitat amb la que la calor passa a través d'un material i depèn únicament de la natura del material i no de la seva forma. Tècnicament, és la quantitat de calor que passa per unitat de temps a través d'una secció de material d'una unitat d'àrea, sotmesa a un gradient de temperatura entre les dues cares. La conductivitat tèrmica es pot definir com la constant de proporcionalitat entre el flux de calor i observar i el gradient de temperatura que el provoca: Conductivitat tèrmica = flux de calor / (gradient de temperatura) o en fórmules, en el supòsit que una barra llarga d amb secció S, i que té els seus dos extrems en contacte amb dues fonts de calor a diferents temperatures:
- Qtaxa és la taxa de transferència de calor o flux de calor (mesurat en watts), és a dir, la quantitat de calor que passa per unitat de temps a través de la secció S de la barra;
- D és la longitud de la barra (és a dir, la distància entre els punts a temperatura T1 i T2), que se suposa uniforme;
- S és l'àrea de la secció transversal de la barra, perpendicular respecte a la direcció del gradient de temperatura, és a dir, la direcció en la qual es mesura la longitud d;
- T1 e T2 són les temperatures en els extrems de la barra.
Propietats magnètiques
[modifica]Alguns metalls presenten propietats magnètiques remarcables com el ferromagnetisme, especialment en el cas del ferro, el cobalt i el níquel a temperatura ambient. Les propietats magnètiques varien quan es fan aliatges, i això s'aprofita per crear imants més potents o per anular el magnetisme del metall, especialment en el cas del ferro.
Ferromagnetisme
[modifica]
El ferromagnetisme és el fenomen pel qual un material pot exhibir un magnetisme espontani, i és una de les formes més fortes de magnetisme i la primera que va ser conguda. És el responsable del comportament que observem als estris magnètics que trobem a la nostra vida diària, i és la base de tots els imants permanents, així com la dels metalls que són atrets per aquests.
El ferromagnetisme es defineix com el fenomen pel qual alguns materials, com el ferro, són magnetitzats quan són posats sota l'acció d'un camp magnètic extern i continuen magnetitzats durant un cert temps un cop ja no hi ha la influència del camp.
En particular, un material és ferromagnètic en sentit estricte només si tots els seus ions magnètics fan una contribució positiva a la magnetització neta que presenta el material. Si alguns dels ions resten magnetització (perquè són parcialment antialineats), llavors el material serà ferrimagnètic. Si els ions són totalment antialineats, i per tant hi ha una magnetització neta igual a zero, malgrat l'ordre magnètic de l'estructura del material, llavors es tractarà d'un material antiferromagnètic. Tots aquest efectes de l'alineació només ocorren per sota de certa temperatura crítica anomenada temperatura de Curie en el cas dels materials ferromagnètics i ferrimagnètics, i temperatura de Néel en el cas dels materials antiferromagnètics.


